Inline-Messtechnik
Hochgeschwindigkeits-Mikroskopie
Bei der Kultivierung von Zellpopulationen spielen die Qualitätskontrolle und Analyse eine wichtige Rolle. Vor allem die Untersuchung großflächigerer Proben bei einer hohen Vergrößerung nimmt viel Zeit in Anspruch. Da Zellkulturplatten häufig von geschultem Fachpersonal untersucht werden, gestaltet dies den Prozess personal- und kostenintensiv und ist anfällig für subjektive Fehler in der Endkontrolle. Durch den Einsatz eines kontinuierlichen Scan-Verfahrens können große Proben schnell und einfach mittels High-Speed-Mikroskopie digitalisiert werden. Anhand nachgelagerter Bildverarbeitungsprozesse lässt sich auch die Analyse der Bilddaten vollständig automatisieren. Dadurch ergeben sich personal- und zeitsparende Prozesse, mit denen sich der Durchsatz größerer Produktionsanlagen steigern und eine reproduzierbare Qualitätskontrolle der Zellen sicherstellen lässt.
Die Technologie der High-Speed-Mikroskopie
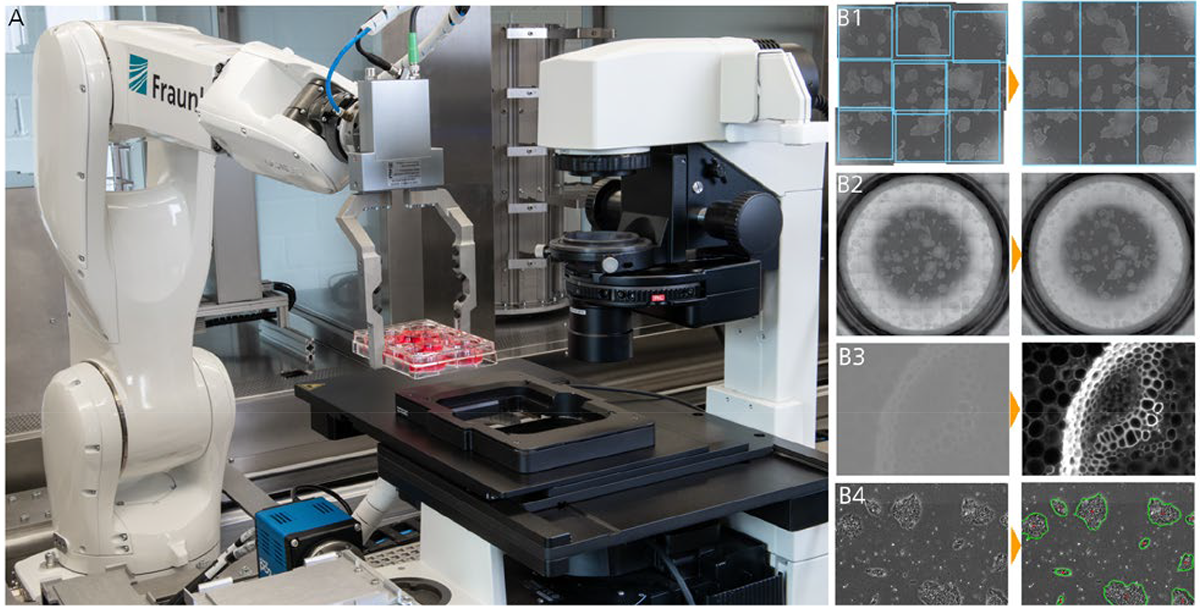
Aufgrund des geringen Sichtfeldes des Mikroskops müssen große Proben stückweise untersucht werden. Herkömmliche Mikroskope verwenden hierbei ein Stop-and-Go-Verfahren, bei dem die einzelnen Bildausschnitte nacheinander angefahren werden, der Fokus justiert wird und anschließend die Bildaufnahme erfolgt. Durch das wiederholte Beschleunigen und Abbremsen ist dieses Verfahren sehr zeitaufwändig und für Proben, die mit Flüssigkeit gefüllt sind, ungeeignet.
Das Fraunhofer IPT hat deshalb ein High-Speed-Mikroskop entwickelt, bei dem die Probe kontinuierlich unter dem Objektiv verfahren wird und Bilder unter Bewegung aufgezeichnet werden. Um Bewegungsunschärfe bei der Bildaufnahme zu vermeiden, kommt eine Blitzlichtquelle mit externer Triggerung und hoher Beleuchtungsstärke zum Einsatz. Die kurze Beleuchtungszeit sorgt dafür, dass die Relativbewegung zwischen Objektiv und Probe die Auflösungsgrenze der Kamera nicht überschreitet und scharfe Bilder entstehen. Zusätzlich wird die Fokuslage für jeden Bildabschnitt dynamisch durch einen z-Piezo-Aktor nachgeführt, um Unebenheiten zu kompensieren und der geringen Tiefenschärfe Rechnung zu tragen. Die Daten für die Fokusnachführung stammen aus einem vorgelagerten Fokusscan, bei dem die Probe durch einen konfokalchromatischen Sensor abgetastet wird, sodass aus den Daten ein Höhenprofil erstellt werden kann [28].
Der Aufbau der Mikroskope
Die Basis bildet der Mikroskop-Körper, der um einen verfahrbaren Probentisch, eine Blitzlichtquelle und eine High-Speed-Kamera erweitert wurde. Mit einem angeschlossenen Computer werden die Messvorgänge gesteuert und die Bilddaten ausgewertet. Ein Controller synchronisiert die Bildaufnahme mit der Beleuchtung und der Fokuskorrektur. Durch den einfachen und vergleichsweise kostengünstigen Aufbau lässt sich eine Vielzahl kommerziell erhältlicher Mikroskope für die High-Speed-Bildaufnahme erweitern und es können verschiedene Aufbauten mit Auflicht-, Durchlicht-, Phasenkontrast- und Polarisationsmikroskopie umgesetzt werden.
Bildverarbeitung
An den Bildaufnahmeprozess schließen sich mehre Post-Processing-Schritte an. Zu diesen zählt die Korrektur von Schattierungen und die Erhöhung des Kontrasts sowie das Stitching, bei dem die Einzelaufnahmen zu einem Gesamtbild zusammengefügt werden. Auch eine integrierte Bildauswertung mit Musterkennung oder KI Algorithmen für individuelle Aufgaben wie die Zellsegmentierung und die Konfluenz-Berechnung ist möglich. Durch die GPU-Unterstützung laufen selbst rechenintensive Prozesse parallel zum Scanvorgang ab und erlauben ein echtzeitfähiges Datenhandling. Die Ergebnisse der Bildverarbeitung liegen dem Benutzer dadurch schon unmittelbar nach dem Scan vor.
Für eine weiterreichende Analyse werden immer häufiger Methoden des Deep Learning eingesetzt. In der Regel müssen solche neuronalen Netze auf den gegebenen Datensatz abgestimmt werden, um eine optimale Performance zu erzielen. Für die erfolgreiche Entwicklung von Deep-Learning-Ansätzen werden Expertinnen und Experten mit ausgeprägtem Domänenwissen benötigt. Das Fraunhofer IPT war an der Entwicklung einer Software beteiligt, die für neue Datensätze eine geeignete Auswahl an Algorithmen vorschlägt und auf den Datensatz anwendet. Zu diesem Zweck wurde eine Entscheidungslogik anhand einer Vielzahl von Deep-Learning-Pipelines zusammen mit domänenspezifischen Anwendungsfällen trainiert. Anwendern ist es dadurch möglich, ohne Spezialkenntnisse im Bereich Künstlicher Intelligenz leistungsfähige Algorithmen für individuelle Anwendungsfälle zu erstellen [29].
Integration in automatisierte Prozesse
Das Mikroskop kann in vollautomatisierten Anlagen zur Analyse der kultivierten Zellen eingesetzt werden. Dies ermöglicht hochdurchsatzfähige Prozesse bei gleichbleibend guter Qualitätskontrolle und dokumentierbaren Qualitätsparametern.
Damit auch die Separation und Entnahme einzelner Zellen auf einer Kulturplatte vollständig automatisiert werden kann, wurde die Integration des laserinduzierten Vorwärtstransfers (LIFT, engl. Laser-induced forward transfer) in das bestehende High-Speed-Mikroskopiesystem erfolgreich getestet. Durch die Integration eines Lasers in den Strahlengang des High-Speed-Mikroskops lassen sich die Analyse und Zellisolation in nur einem Gerät vereinen, ohne dass eine zusätzliche Probenpräparation erforderlich ist. Bei diesem Verfahren wird gepulste Laserstrahlung verwendet, die auf die Grenzfläche zwischen der Mikrotiterplatte und dem Zellmedium gerichtet wird, um Zellen über einen Luftspalt zwischen zwei Oberflächen zu transportieren [30].
Adaptive Phasenkontrastmikroskopie
Die Phasenkontrast- und die Fluoreszenzmikroskopie zählen zu den wichtigsten Verfahren für die Analyse biologischer Proben und zur Beobachtung lebender Zellen. Im Gegensatz zur Fluoreszenzmikroskopie erfordert die Phasenkontrastmikroskopie jedoch keine Fluoreszenzmarkierungen und ist daher schonender für die automatisierte Kultivierung hochwertiger Zellen. Allerdings wird die Beobachtungsfläche durch den sogenannten »Meniskuseffekt« auf die Mitte der Zellgefäße beschränkt. Die Bestimmung der Qualitätsparameter außerhalb dieses Bereichs ist dadurch erschwert.
Das Fraunhofer IPT forscht an Verfahren in der adaptiven Phasenkontrastmikroskopie, um die mikroskopisch sichtbare Fläche erheblich zu vergrößern. Damit die Methode auch in automatisierten Anlagen angewandt werden kann, ist es Ziel in einem laufenden Forschungsprojekt, das Verfahren hochdurchsatzfähig zu gestalten [31].
Ausblick auf weitere Entwicklungen
Obwohl das Verfahren bereits heute schneller ist, als vergleichbare Stop-and-Go-Verfahren arbeitet das Fraunhofer IPT immer weiter daran, die Aufnahmeprozesse zu verbessern. Durch die einfache Erweiterungsfähigkeit von Mikroskopiesystemen können in Projekten individuelle Lösungen für verschiedene Branchen entwickelt werden. Dabei kann auf eine Vielzahl kundenbezogener Anforderungen eingegangen und die High-Speed-Mikroskopie in bestehende, automatisierte Anlagen integriert werden.