Die Produktionslandschaft der Lebenswissenschaften
Die Lebenswissenschaften mit all ihren unterschiedlichen Disziplinen vereint das gemeinsame Ziel, Umgebungen, Prozesse oder Produkte zu verbessern, die in direktem Kontakt mit lebenden Organismen stehen. Das breite Themenspektrum geht mit sehr unterschiedlichen wissenschaftlichen und technischen Herausforderungen einher. Deshalb sind auch die Produktionstechnologien für die verschiedenen Aufgaben der Lebenswissenschaften unterschiedlich weit entwickelt. Dies betrifft besonders Kriterien wie die Skalierbarkeit, den Digitalisierungsgrad, die Reproduzierbarkeit und die Nachhaltigkeit der Produktionstechnologien, -systeme und -verfahren.
In der chemischen Industrie oder bei der Herstellung einfacher medizintechnischer Produkte sind die Produktionsstätten technologisch oft sehr weit entwickelt und folgen vielen Ansätzen, die sich unter dem Begriff »Industrie 4.0« zusammenfassen lassen. Fachrichtungen, die stärker an die Biologie angrenzen, liegen hingegen beim Reifegrad ihrer Industrialisierung weiter zurück. Dafür gibt es verschiedene Gründe:
- Biologische Variabilität
- Personalisierung/Individualisierung
- Komplexität und Zeitsensitivität der Herstellungsprozesse
- Neuheits- und Innovationsgrad der Produkte
- Qualitätsstandards und regulatorische Hürden
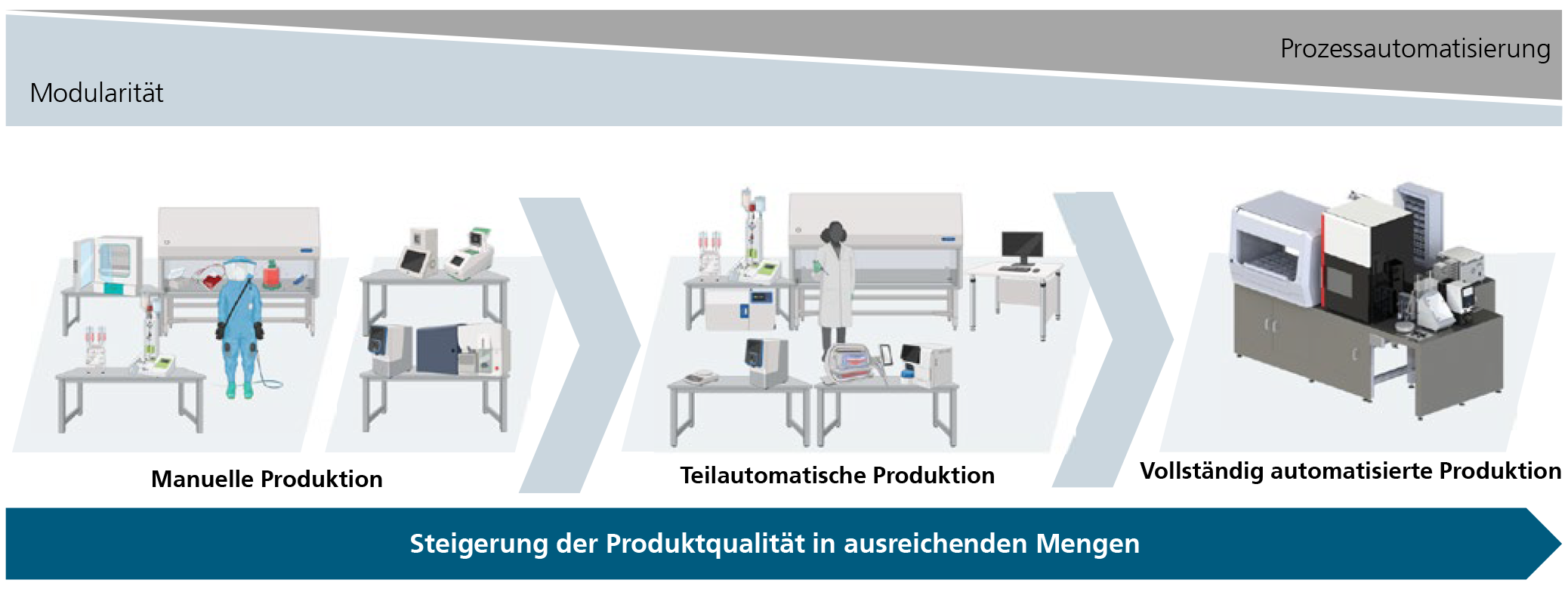
Daher sind die Produktionsverfahren biologischer oder biohybrider Produkte häufig noch durch viele manuelle Prozessschritte geprägt. Viele Produkte werden also dauerhaft im Labor hergestellt und nicht in einer industriellen Produktionsumgebung. Zwar ist die Herstellung im Labor flexibler und anpassungsfähiger, jedoch können nur schwer hohe Durchsätze erzielt werden. Gleichzeitig ist der Arbeits- und nicht zuletzt auch der Personalaufwand dadurch sehr hoch.
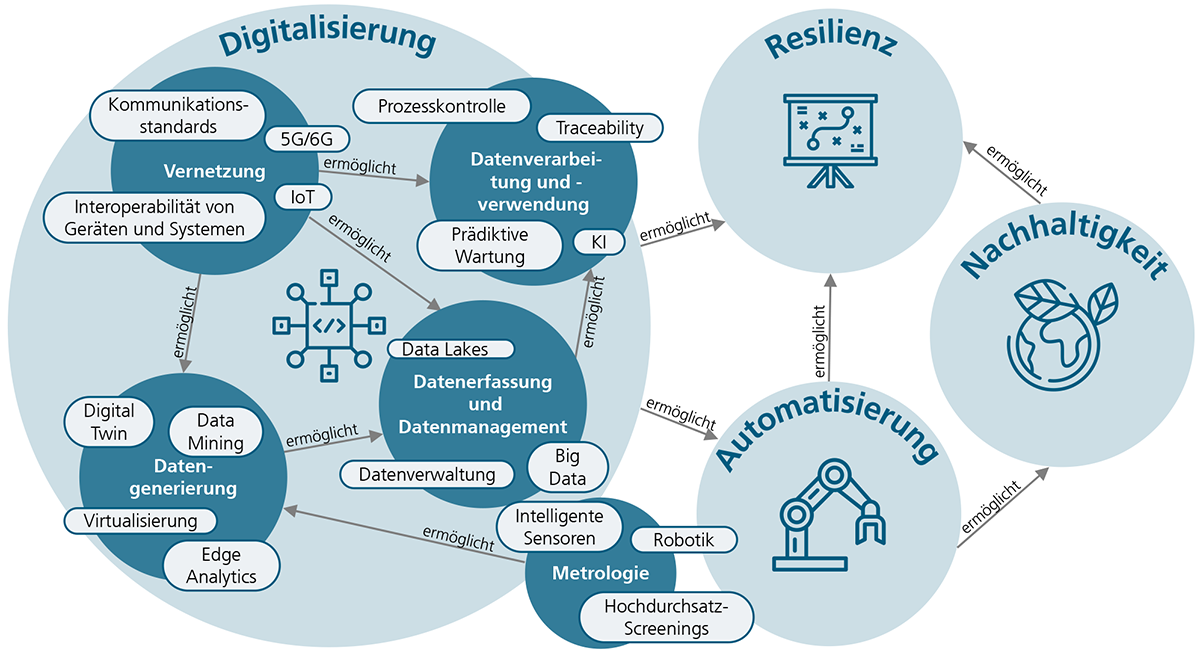
Dieser Trendreport beschreibt die Vision der modernen biotechnologischen Produktion, die die Vorteile des Labors mit denen industrieller Herstellungsprozesse vereint.