Laborautomatisierung zur Produktivitätssteigerung
Die Herstellung von Biopharmazeutika ist regelmäßig ein hochkomplexer und ressourcenintensiver Prozess, der präzise und zuverlässige Laborarbeiten erfordert. Angesichts steigender Anforderungen an Qualität, Effizienz und Geschwindigkeit gewinnt die Laborautomatisierung immer mehr an Bedeutung. Durch den Einsatz automatisierter Technologien können moderne Biolabore repetitive und zeitaufwändige Aufgaben schneller und präziser durchführen und ihre Produktivität erheblich steigern. Die Automatisierung ermöglicht eine höhere Reproduzierbarkeit der Ergebnisse, minimiert menschliche Fehler und steigert die Datengenauigkeit, was entscheidend für die Einhaltung regulatorischer Anforderungen ist. Zudem werden Arbeitskräfte entlastet und können sich auf komplexere Aufgaben konzentrieren, was die Innovationskraft des Unternehmens stärkt. Da manuelle Produktionsumgebungen aktuell noch immer üblich sind, bietet die Laborautomatisierung einen entscheidenden Wettbewerbsvorteil und ermöglicht es biopharmazeutischen Unternehmen, effizienter und kostengünstiger zu arbeiten, was besonders in einem wettbewerbsintensiven Marktumfeld von entscheidender Bedeutung ist.
ATMPs (Advanced Therapy Medicinal Products) sind innovative, biotechnologisch hergestellte Arzneimittel, die neue Möglichkeiten zur Behandlung schwerer, bisher unheilbarer Krankheiten wie beispielsweise Krebs eröffnen. Sie basieren auf Zell- und Gentherapie sowie Tissue Engineering. In der Europäischen Union unterliegen ATMPs einer besonderen Regulierung, um ihre Sicherheit und Wirksamkeit zu gewährleisten. Dies führt zu hohen Produktionsanforderungen und -aufwänden, die eine Automatisierung der Produktion in diesem Bereich besonders relevant werden lassen.
Vorteile der Prozessautomatisierung in der Biopharmazeutika- oder ATMPs-Herstellung:
- Höhere Produktivität und Effizienz des Prozesses:
Automatisierung ermöglicht die schnellere und präzisere Durchführung repetitiver und zeitaufwändiger Aufgaben. - Verbesserung der Produktqualität:
Durch die Reduzierung menschlicher Fehler können konsistente Ergebnisse erzielt werden. Dies ist besonders wichtig für die Qualitätssicherung und die Einhaltung strenger regulatorischer Anforderungen. - Wettbewerbsvorteile:
Effizientere Prozesse senken die Produktionskosten, insbesondere in wettbewerbsintensiven Märkten. Mitarbeiterinnen und Mitarbeiter werden entlastet und können sich auf komplexere, kreativere und wertschöpfendere Aufgaben konzentrieren. Die Konzentration auf anspruchsvollere Aufgaben stärkt die Innovationskraft des Unternehmens.
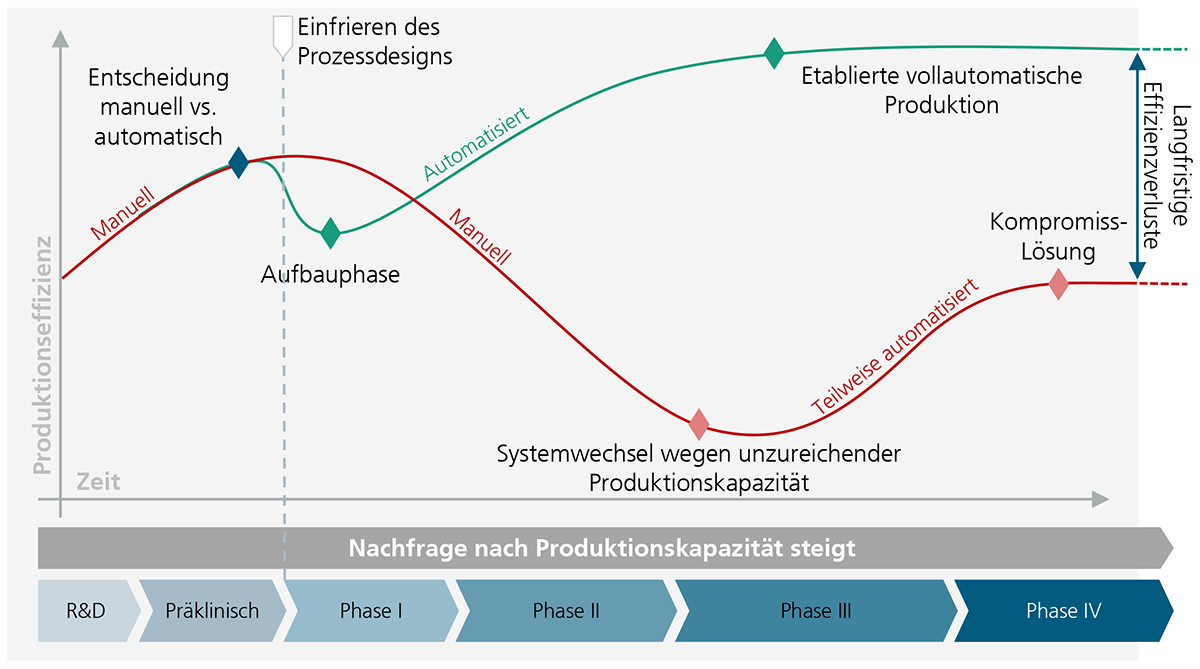
Abbildung 10 verdeutlicht qualitativ, dass es aus produktionstechnologischer Sicht sinnvoll ist, bereits möglichst früh im Produktentstehungsprozess eine automatisierte Herstellung zu etablieren. Bei der Entwicklung eines neuen Biopharmazeutikums ist in der Erforschung sowie in der Phase der präklinischen Zulassung ein manueller Betrieb durchaus effizient und sinnvoll. Beim Übergang in die klinischen Studien, muss der Herstellungsprozess klar definiert sein und kann später nur noch unter hohem regulatorischem Aufwand verändert werden. Ist der Prozess bis zu diesem Zeitpunkt also noch nicht für eine Automatisierung ausgelegt, muss die Produktion längerfristig manuell betrieben werden.
Da mit Voranschreiten der klinischen Studien immer mehr Produkte benötigt werden, müssen die Produktionskapazitäten ebenfalls wachsen. Dies führt dazu, dass neue Labore ausgestattet und weitere Fachkräfte eingestellt werden müssen, oder dass teure Herstellungsaufträge an CDMOs vergeben werden müssen. All dies reduziert die Produktionseffizienz.
Wenn zu einem späteren Zeitpunkt unter großen Bemühungen teilautomatisierte Lösungen etabliert werden, kann langfristig dennoch keine Produktionseffizienz erreicht werden, die einer vollautomatisierten Lösung nahekommt.
Ökonomische Betrachtungen von Laborautomatisierungen zeigen, dass bereits durch die Installation einzelner Automatisierungslösungen, sogenannter Automatisierungsinseln, bis zu 17 Prozent der jährlichen Kosten eingespart werden können – und das obwohl teilweise neue, teure Geräte dafür angeschafft werden müssen. Diese Beobachtung bezieht sich auf ein klassisches, nicht automatisiertes Biolabor, in dem häufig neue Prozesse ausgeführt und keine Standard Operating Procedures (SOPs) für die Herstellung eines konkreten Produkts abgearbeitet werden [21]. In Fällen, in denen Laborarbeiten in erster Linie auf die Produktion eines Produkts ausgerichtet sind, welches möglichst effizient gemäß SOP gefertigt werden soll, ist eine vollständige Automatisierung aus ökonomischer Sicht sinnvoller. Eine Wirtschaftlichkeitsbetrachtung der Herstellung von menschlich induzierten pluripotenten Stammzellen (hiPSCs) hat gezeigt, dass die Gesamtkosten im Vergleich zwischen manueller und der vollautomatisierter Produktion über einen Zeitraum von acht Jahren um circa 40 Prozent gesenkt werden konnten [22]. Diese Automatisierungslösung hat das Fraunhofer IPT zusammen mit Partnern in der »StemCellFactory« umgesetzt, die im folgenden Kapitel näher vorgestellt wird.